Rybelsus (semaglutid për përdorim nga goja): rreziku për gabimet në mjekim që lidhen për shkak të futjes së formulës së re me biodisponueshmëri të rritur
Përmbledhje:
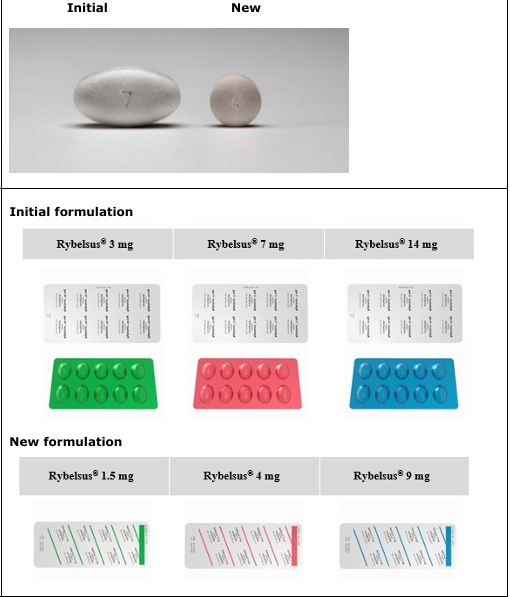
- Tabletat Rybelsus do të zëvendësohen me një formulë të re me biodisponueshmëri të rritur, e cila është bioekuivalente me formulën fillestare siç përshkruhet në tabelën më poshtë:
| Formula fillestare (një tabletë ovale) | Bioekuivalent | Formulë e re (një tabletë e rrumbullakët) |
| 3 mg (doza fillestare) | = | 1.5 mg (doza fillestare) |
| 7 mg (doza e mirëmbajtjes) | = | 4 mg (doza e mirëmbajtjes) |
| 14 mg (doza e mirëmbajtjes) | = | 9 mg (doza e mirëmbajtjes) |
- Formulimi i ri ka të njëjtën efikasitet, siguri dhe metodë administrimi si formulimi fillestar.
- Rybelsus duhet të përdoret gjithmonë një tabletë në ditë.
- Të dy formulimet do të bashkëjetojnë përkohësisht në treg, gjë që mund të shkaktojë ngatërresa. Kjo mund të rezultojë në mbidozë, gjë që rrit rrezikun e ngjarjeve të padëshiruara.
- Pacientët që aktualisht marrin Rybelsus duhet të informohen dhe të këshillohen për ndryshimin në formulë dhe dozë kur të përshkruhet ose shpërndahet formula e re.
- Pacientëve që fillojnë trajtimin me Rybelsus duhet t’u përshkruhet formula e re dhe të informohen siç duhet nga mjeku që e përshkroi barin ose farmacisti.
Informacion mbi sigurinë
Rybelsus është për trajtimin e të rriturve me diabet mellitus tip 2 të pakontrolluar mjaftueshëm si një shtesë e dietës dhe ushtrimeve.
Novo Nordisk po zëvendëson formulën fillestare (tableta 3 mg, 7 mg, 14 mg) të Rybelsus me formulën e re (tableta 1.5 mg, 4 mg, 9 mg).
Në krahasim me formulën fillestare, eksipientët në formulën e re janë modifikuar për të rritur përthithjen. Formula e re ka rritur biodisponueshmërinë, duke rezultuar në doza më të ulëta për të arritur të njëjtin ekspozim ndaj barit. Bioekuivalenca është treguar në një provë klinike dhe dozat e formulës së re kanë të njëjtën efikasitet dhe siguri si formula fillestare. Kjo do të thotë që të dhënat e përditësuara në programin e provës klinike të fazës 3 të Rybelsus janë të zbatueshme për formulën e re. Kjo lejon kalimin midis dozave përkatëse të formulës fillestare dhe formulës së re. Metoda e administrimit mbetet e njëjtë.
Bashkëekzistenca e të dy formulimeve gjatë periudhës së tranzicionit mund të çojë potencialisht në konfuzion dhe të paraqesë rrezik për gabime në mjekim. Gabimet në mjekime mund të rezultojnë në rritje të ekspozimit ndaj semaglutidës, gjë që mund të çojë në efekte anësore gastrointestinale, si p.sh. të përziera, të vjella dhe diarre.
Informacioni i Produktit është përditësuar për të shpjeguar ndryshimin midis dy formulimeve dhe për t’u mundësuar lexuesve të identifikojnë dozat ekuivalente në të gjitha formulimet me doza bioekuivalente.
Paketimi dhe forma e tabletës për formulën e re ndryshojnë nga formula fillestare, por ngjyra e hapave të ndryshëm të dozimit është mbajtur e ngjashme. Shih tabelën më poshtë.
| Madhësia e tabletës:Tabletat për formulën e re janë më të vogla në madhësi dhe kanë një formë të ndryshme(të rrumbullakëta). |
| Paketimi primar: Formulimi i ri i blisterave janë argjendi si në pjesën e përparme ashtu edhe në pjesën e pasme dhe janë më të vogla krahasuar me blisterat me formulën fillestare. |
Raportimi :
Raportimi i efekteve të padëshiruara të dyshuara përfshirë gabimet në mjekim që lidhen me Rybelsus është i rëndësishëm. Ai lejon monitorimin e vazhdueshëm të bilancit risk/përfitim të barit. Profesionistët e kujdesit shëndetësor duhet të raportojnë çdo efekt të padëshiruar të dyshuar nëpërmjet sistemit kombëtar të raportimit në faqen zyrtare të AKBPM. https://vigiflow-eforms.who-umc.org/al/aladr
Lista e barnave që kanë autorizim për Tregtim në RSH që përmbajnë lëndën aktive SEMAGLUTIDE :
RYBELSUS, Tablets x 3 mg
RYBELSUS, Tablets x 7 mg
RYBELSUS, Tablets x 14 mg